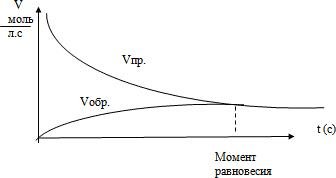
Cабақтың тақырыбы: Theme of the lesson | Factors affecting chemical equilibrium. Le Chatelier-Brown principle.Laboratory work 3: Examining the dynamic equilibrium shift under various factors | ||||||||||||||||||||||||||||||||||||
Сабақта қол жеткізетін оқу мақсаттары: Learning objectives that are achieved at this lesson (Subject Programme reference) | 10.3.3.2 химиялық тепе-теңдікке температура, концентрация және қысым өзгерісінің әсерін болжау; 10.3.3.3 не себепті катализатор тепе-теңдіктің тез орнауына әсер ететінін, бірақ ығысуына әсер етпейтіндігін түсіндіру; 10.3.3.4 әр түрлі факторлардың тепе-теңдіктің ығысуына әсерін тәжірибе жүзінде зерттеу 10.3.3.4 observe experimentally devise and carry out an experiment on the impact of different factors on equilibrium shift; | ||||||||||||||||||||||||||||||||||||
Оқу мақсаттары Lesson objectives | By the end of the class students should:
| ||||||||||||||||||||||||||||||||||||
Бағалау критерийлері Success criteria | Students should...
| ||||||||||||||||||||||||||||||||||||
Тілдік мақсаттар Language objectives |
| ||||||||||||||||||||||||||||||||||||
Құндылықтарды дарыту Values instilled at the lesson | Сыйластық - Respect; Ынтымақтастық - Cooperation; Ашықтық - Openness; Еңбек және шығармашылық - Work and creativity; Үйренгенді өз өмірде қолдану - Learning throughout life. | ||||||||||||||||||||||||||||||||||||
Пәнаралық байланыстар Cross-curricular links | Физикалық Physics | ||||||||||||||||||||||||||||||||||||
Акт дағдылары ICT skills | Презентация Presentation
| ||||||||||||||||||||||||||||||||||||
Алдыңғы оқу
Previous learning | «Тепе-теңдік»“Equilibria” |
Сабақ кезеңі/Уақыты Lesson period / Time | Педагогтің іс-әрекеті Teacher's actions | Оқушының іс-әрекеті Student actions | Бағалау Assesment | Ресурстар
Resources
| ||||||||||||||||||||||||
Сабақтың басы Қызығушылықты ояту 7 мин.
The beginning of the lesson | (Ұ). Ұйымдастыру кезеңі: - Good morning students. How are you? .We begin our lesson.
Organizational stage: 1. Greeting students, inventory. 2. In creating an atmosphere of cooperation, a circle of joy is realized. 3. Group students
(P) Оқушылардың алдыңғы білімдері бойынша кері байланыс ретінде жұптарда интерактивті тақтадағы тапсырмаларды орындайды. Орындалу уақыты:4 минут
Тапсырма. Берілген химиялық реакция теңдеулерін қайтымды/қайтымсыз реакцияларға жіктеңіздер: Starter: • Revision of previous learning about “Equilibria” through overall explanation of reversible reactions and equilibria
| The group is given a section of paper with the symbols of Factors affecting chemical equilibrium, Le Chatelier-Brown principle,. Each student is divided into 2 groups with their own symbols. Group 1: Factors affecting chemical equilibrium, Top 2: Le Chatelier-Brown) principle | |
Textbook, workbook A set of cross-sections of paper with the symbols of Factors affecting chemical equilibrium, Le Chatelier-Brown principle,.
PowerPoint | ||||||||||||||||||||||||
Жаңа сабаққа кіріспе Introduction to a new lesson
| Жаңа тақырыпқа шығу: Go to a new topic Берілген сурет бойынша сабақ тақырыбын анықтаңыз. What we saw is this picture?
1. What is a reversible reaction? 2. What is an irreversible reaction? 3. What is chemical equilibrium? 4. What are the conditions that affect the shift of the chemical equilibrium?
Терминдермен жұмыс
(Ұ) «Миға шабуыл» әдісі арқылы
| Оқушыларға «Габер процесі» бойынша бейнебаяннын көреді
Watch the video and answer the questions
Оқушылар осы термин сөздерді пазлдан тауып шығады | Қалыптастырушы бағалау: formative grading Өз ойын дұрыс мағынада білдіріп, талқылауға белсенділікпен қатысқан оқушыға «Жарайсың!» деген мадақтау сөзімен ынталандыру. Well done, good job,
you can do everything |
Video
PowerPoint | ||||||||||||||||||||||||
Сабақтың ортасы Мағынаны ашу. 20 мин.
Middle | №3 Зертханалық жұмыс Әр түрлі факторлардың динамикалық тепе-теңдік күйіне әсерін зерделеу №3 Laboratory work ( Химиялық тепе-теңдікке әсер факторларды өзара талдау, теориялық ақпаратпен танысу.
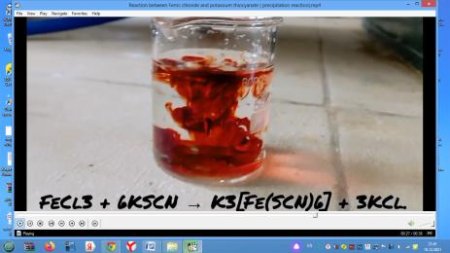
Мұғалім көрсетілімі. Көрсету №1
3KSCN + FeCl3 = 3KCl + Fe(SCN)3↓ түссіз сары түссіз қан-қызыл
Бейне баян бойынша сабақ зертханалық тақырыбын айқындау.
| Оқушылар Химиялық тепе-теңдікке әсер факторларды өзара талқылайды, теориялық ақпаратпен танысады жұмыс дәптеріне жазып отырады |
Дескриптор: -Көрсетілімді көреді -Сұрақтарға жауап береді. Жалпы – 4балл | Бейне көрсетілім 10-сынып оқулығы. Жұмыс дәптерлері | ||||||||||||||||||||||||
Жеке жұмыс 6 мин Individual work | Оқушыларға сұрақ: 1. Химиялық реакция деген не? 2. Химиялық реакция жүруінің белгілері қандай? 3. Химиялық реакциялар қалай жіктеледі? 4. Берілген химиялық реакциялардың қайсысы қайтымды, неге? NaOH + HCl —>NaCl + H2O
| Оқушылар ауызша қалыптастырушы бағалау жұмысын орындайды. | Дескриптор: -химиялық реакциялардың қайтымды екенін ажырата алады -2б -химиялық реакциялардың жіктей алады- 1б -химиялық реакцияға анықтама жазады- 1б
| 10-сынып оқулығы. Жұмыс дәптерлері | ||||||||||||||||||||||||
Жұппен жұмыс Work in pairs | 1-есеп .Қай фактордың (қысым, температура,катализатор) әсері: СО2 (г)+С (к) ↔ 2CO (г) ∆Н°=159 кДж Реакциясында орнаған тепе-теңдікті СО түзілуі жағына ығыстырады.
2-есеп. Келесі реакция теңдеулерінің тепе-теңдік константаларының өрнектерін жазыңдар: Шешуі:
|
| ||||||||||||||||||||||||||
Сабақтың соңы Ой толғаныс. Рефлексия 7 мин.
End of lesson
| «Бір ауыз сөз» әдісі. Мұғалім сабақты қорытындылау мақсатында оқушылардың сабаққа деген көзқарасын, рефлексиясын тыңдайды. Мақсаты: Оқушы алған білімін саралай білуге дағдыланады. Тиімділігі: Тақырып бойынша оқушылардың пікірін анықтайды. Жинақталған деректердің құнды болуын қадағалайды. Саралау: Бұл кезеңде саралаудың «Қорытынды» тәсілі көрінеді. | Жеке жұмыс: Оқушылар бір ауыз сөзбен сабақ туралы өз ойларын түсіндіріп береді. Бір ауыз сөздеріне сабақты бағалайтын келесі сөздерді айтуға болады ұнады, пайдалы, қажет, білдім, үйрендім, қызықтым, ұмтылдым, есте сақтадым, жасай аламын. т.б. | Мұғалім оқушылардың сабаққа қатысқан белсенілігіне қарай 1-10 баллдық жүйе бойынша әр оқушының өзіне тиісті баллын қойып бағалайды. СОнымен қатар, оқушыларды ынталандыру үшін «Қошеметтеу» әдісі арқылы бағалайды.
|
|
Differentiation – how do you plan to give more support? How do you plan to challenge the more able learners? | Assessment – how are you planning to check students’ learning? | Health and safety regulations | |
Differentiation can be by task, by outcome, by individual support, by selection of teaching materials and resources taking into account individual abilities of learners (Theory of Multiple Intelligences by Gardner). Differentiation can be used at any stage of the lesson keeping time management in mind. | Use this section to record the methods you will use to assess what students have learned during the lesson. | Health promoting techniques Breaks and physical activities used. Points from Safety rules used at this lesson. | |
Reflection
| Use the space below to reflect on your lesson. Answer the most relevant questions from the box on the left about your lesson. | ||
| |||
Summary evaluation What two things went really well (consider both teaching and learning)? 1: 2: What two things would have improved the lesson (consider both teaching and learning)? 1: 2: What have I learned from this lesson about the class orachievements/difficulties of individuals that will inform my next lesson? | |||
№3 Зертханалық жұмыс Әр түрлі факторлардың динамикалық тепе-теңдік күйіне әсерін зерделеу
№3 Laboratory work observe experimentally devise and carry out an experiment on the impact of different factors on equilibrium shift;
Әрекеттесуші заттар концентрациясының әсері
Реактивтер: Темір (ІІІ) хлориді, калий роданиді (KSCN) 0,01 M , 1M ерітінділері 5 грамм калий хлоридінің кристалдары
Химиялық ыдыстар мен зертханалық құрал жабдықтар: 500 мл, 250 мл стақандар; өлшегіш 25 мл цилиндрлер, шыны таяқша, ақ экран
Жұмыс барысы
Не істелді? Experiment progress
| Не байқалды?What are you watching?What is colour? | Қорытынды Reaction equation
|
3KSCN + FeCl3 = 3KCl + Fe(SCN)3↓ |
түссіз сары түссіз қан-қызыл
colourless, yellov, red
| 3KSCN + FeCl3 = 3KCl + Fe(SCN)3↓ |